群馬大学大学院理工学府物質・環境部門
理工学部 物質・環境類 応用化学プログラム
生物有機化学研究室(高橋剛研究室)
群馬大学大学院理工学府物質・環境部門
理工学部 物質・環境類 応用化学プログラム
生物有機化学研究室(高橋剛研究室)
研究内容

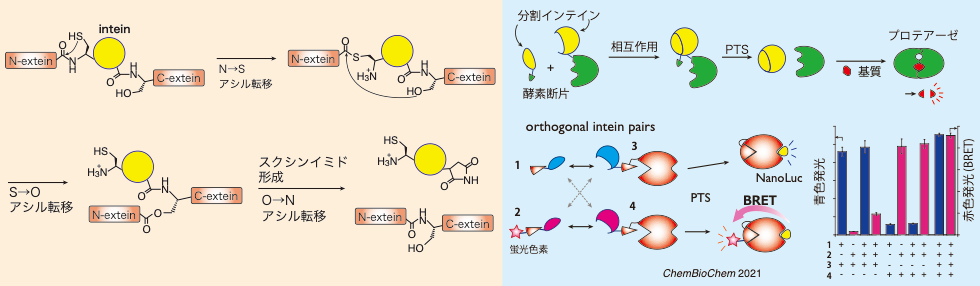
インテインは、タンパク質のスプライシング反応を自己触媒するタンパク質です。インテインの反応により、NエクステインとCエクステインがペプチド結合で連結します(図左)。インテインの中には、2つのドメインに分かれた分割インテインがあり、2つのポリペプチド鎖が分割インテインの部分で会合することで、エクステイン同士を繋げることができます。この反応は、protein trans-splicing(PTS)と呼ばれています。私たちの研究室では、新しい分割インテインの開発を行っています(図右)。新規に開発した分割インテインによるPTS反応を利用して、プロテアーゼの活性(図右上)や発光タンパク質であるルシフェラーゼの活性(図右下)などをPTS反応で制御する系の構築を行っています。この系を使って、細胞内の酵素反応や、ペプチド−タンパク質間の相互作用を簡便に検出する方法を開発しています。
タンパク質スプライシング活性をもつインテインの利用
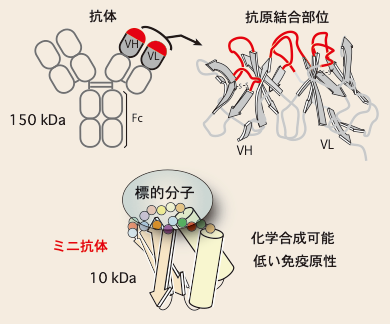
抗体は、相手となる抗原を厳密に見分けて結合することができます。この高い分子認識能を利用して様々な抗体医薬が開発され、がんなどの治療薬として利用されています。一方で、抗体分子は複雑な構造をもっており、また分子量も大きいため、調製が難しく、抗体医薬をつくるためのコストが問題となってきます。
私たちの研究室では、アミノ酸配列を一から構築したデノボタンパク質を創製する研究に取り組んでおり、これまでにアミノ酸残基数100程度で、天然様の高次構造を形成する人工タンパク質の作製に成功しています。このタンパク質は、化学合成が可能な大きさで、かつ免疫原性が低いことが分かっています。そこで、この人工タンパク質をスキャフォードとして、抗体様の分子認識場を作製し、優れた分子認識能をもつ人工タンパク質(ミニ抗体)の創製を目指しています。
デノボタンパク質を土台としたミニ抗体の創製


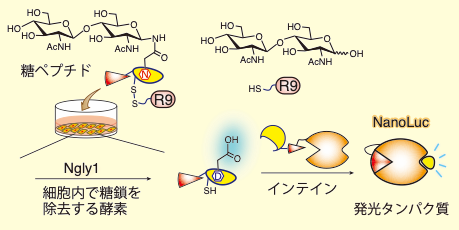
N結合型糖鎖とAsn側鎖の結合を切断する脱糖鎖酵素であるペプチド:N-グリカナーゼ(PNGase, Ngly1)活性を検出する方法として、分割インテインを用いた方法を開発しました(Chem. Commun., 2022)。11アミノ酸からなるN末端側インテインに、GlcNAc2残基を導入したペプチドは、C末端インテインとの相互作用が起きにくく、PTSの反応速度が低下します。その結果、PTS産物であるルシフェラーゼの生成量も少なく、低い発光値を示します。糖鎖をもつペプチドにNgly1が作用すると、糖鎖が切り出され、効率良くPTSが進行し、ルシフェラーゼが多く生成し、高い発光値が観測されます。これを利用して、Ngly1の酵素活性を簡便に調べることができます。

